Vers une meilleure compréhension des mécanismes d’intercalation des ions aluminium
Les batteries à ion aluminium (Al-ion) constituent une solution de stockage électrochimique de l’énergie à haute densité d'énergie, sûre et durable. L’aluminium est notamment le métal le plus abondant sur Terre. De fait, les batteries Al-ion pourraient être une alternative crédible aux batteries lithium, présentes aujourd’hui dans tous nos appareils électriques portatifs. Si les performances de cette dernière technologie sont pour le moment inégalées, le lithium reste un élément chimique peu abondant et inégalement réparti sur notre planète.
Le développement de dispositifs Al-ion commerciaux nécessite encore de concevoir des matériaux d'électrodes positives (ou cathodes) appropriés capables d’insérer de manière réversible des ions Al3+. Ces ions interagissent fortement avec le sous réseau anionique, ce qui induit une faible diffusion dans les matériaux hôtes, limitant ainsi les capacités pratiques obtenues.
Bien que ces dispositifs soient théoriquement prometteurs, la chimie d’intercalation de l’ion Al3+ est encore mal comprise. La stratégie proposée pour identifier de nouveaux matériaux d’électrodes positives est la suivante : D’abord, acquérir une compréhension détaillée de la chimie d'intercalation et chercher à comprendre l'environnement chimique local de l'Al inséré dans des matériaux modèles, et ensuite, comprendre comment cela affecte les performances électrochimiques.
Une équipe internationale emmenée par le laboratoire PHENIX (Sorbonne Université), membre du RS2E (le Réseau français sur le stockage électrochimique de l’énergie), a étudié en profondeur les mécanismes d’insertion de l’ion Al dans un réseau d’oxyde de titane modifié permettant de mettre en évidence les facteurs clés affectant les propriétés d’intercalation de ces ions. Les chercheurs en ont ainsi identifiés deux : La nature des anions environnant les sites d'insertion et le pouvoir de polarisation des ions Al3+ affectant le nombre total d'ions insérés. Leur travail détaillé a été publié dans la revue Angewandte Chemie.
Les défauts structuraux comme outils pour mieux comprendre la chimie d’intercalation
Lors de recherches précédentes, les chercheurs ont modifié un oxyde de titane (TiO2) par substitution anionique pour créer un grand nombre de lacunes cationiques dans le réseau. Cette approche a permis de multiplier par trois, en théorie, le nombre de sites dans lesquels les ions Al3+ peuvent s’insérer dans la structure.
L’étude publiée dans Angewandte Chemie s’est quant à elle attelée à décrire de manière fine les mécanismes d’insertion des ions Al3+ avec, en particulier, des techniques locales telles que la fonction de distribution des paires, la résonance magnétique nucléaire du noyau 27Al ainsi que des calculs DFT.
Les résultats montrent un mécanisme d'insertion complexe influencé par différents facteurs impliquant une variété de sites d'insertion : Les sites lacunaires isolés et à double paires adjacentes ainsi que les sites interstitiels natifs. Malheureusement, l’oxyde de titane modifié ne peut en fait pas insérer de manière optimale tous les ions Al3+ attendus.
La raison avancée par les chercheurs est que l’insertion d’un ion Al3+ dans un des deux sites lacunaires adjacents s’accompagne d’une distorsion locale du réseau empêchant un deuxième ion de s’intercaler dans le site encore inoccupé. Le matériau d’électrode pourra donc insérer moins d’ions Al3+ que prévu, ce qui va limiter ses performances de stockage de l’énergie.
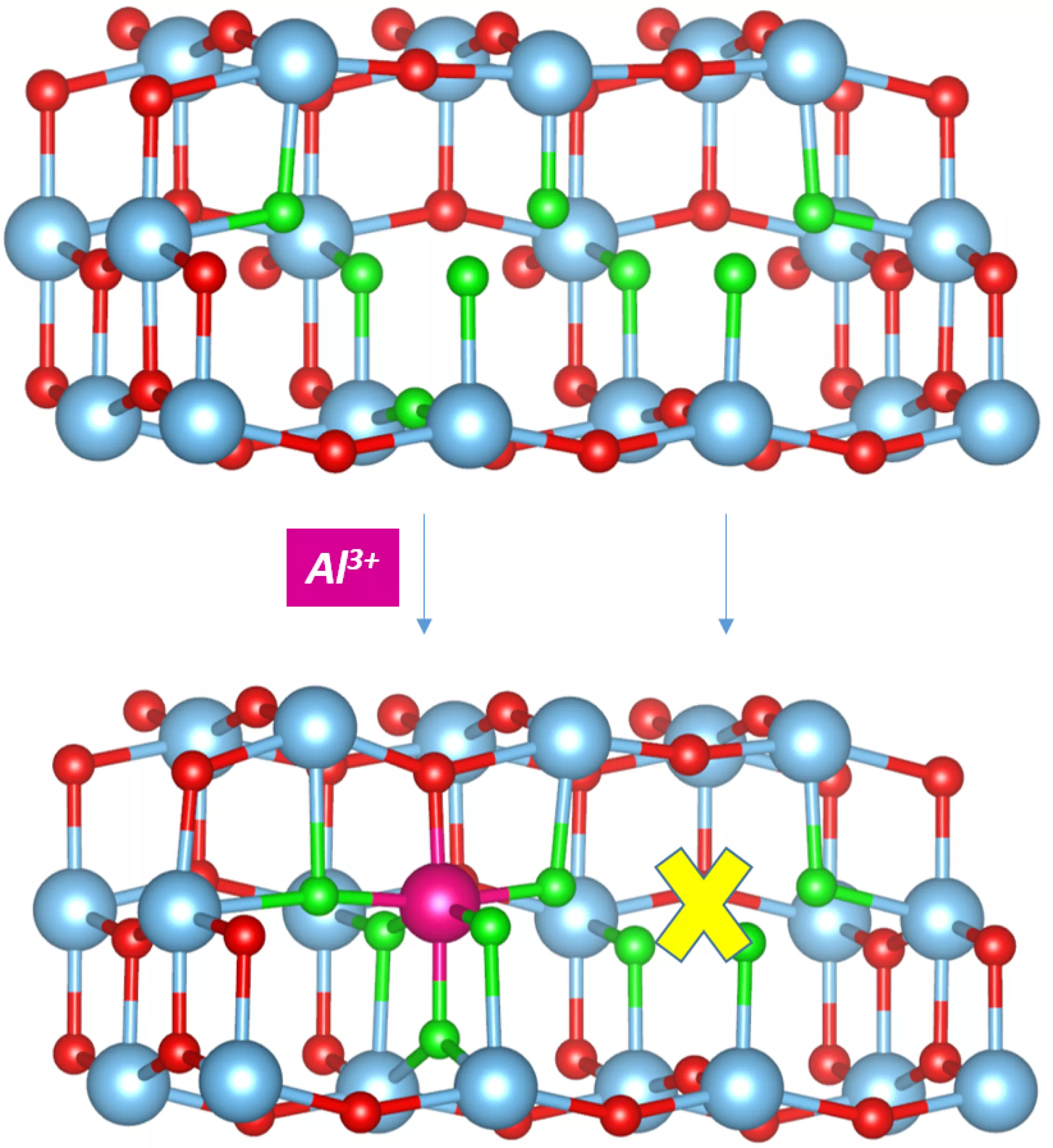
Figure 1 : L’insertion d’un ion Al3+ dans l’un des deux sites lacunaires adjacents provoque une distorsion du réseau qui empêche le second site d’être occupé
Ces résultats, en permettant de mieux comprendre la chimie d’intercalation de l’ion Al3+ et ses limites, peuvent servir de guide pour concevoir de nouveaux matériaux plus performants qui pourraient aboutir à la commercialisation de batteries Al-ion fonctionnelles.
---
Références :
Atomic Insights into Aluminium-Ion Insertion in Defective Anatase for Batteries
Christophe Legein et al.
Angewandte Chemie, 10/07/2020, DOI : 10.1002/anie.202007983
Contact : Damien Dambournet, damien.dambournet@sorbonne-universite.fr